Анализ проб рудничного воздухаПоступившие в лабораторию пробы газа подвергаются анализу по одному из следующих способов:
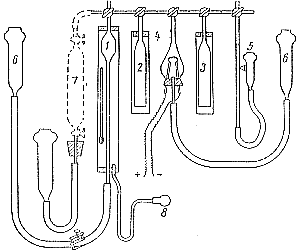
Схема стандартного газоаналитического прибора, используемого в газоаналитических лабораториях горноспасательных частей показана на рис 47. Он состоит из измерительной бюретки 1 емкостью от 35 до 50 см3 с пузырем, занимающим 75% объема бюретки, и нижней градуированной части с ценой деления 0,1% обшей емкости, поглотительных сосудов 2 и 3, coжигательного сосуда 4, манометра 5 и ртутных давильных сосудов 6. Пипетка с пробой анализируемого воздуха 7 присоединяется к бюретке 1 (защищенной от колебаний температуры водяной рубашкой, снабженной грушей для перемешивания 8), с помощью которой из пипетки забирается определенный объем газа, который затем последовательно вытесняется в поглотитель 2, сожигательный сосуд 4 и поглотитель 3, где производится соответственно поглощение СО2 (25%-м раствором едкого калия), сожигание метана (при помощи питаемой через трансформатор на 6 в раскаденной платиновой спирали с диаметром проволоки 0,3 мм) и поглощение кислорода (щелочным раствором пирогаллола C6H3(OH)3 или раствором гидросернистого натрия Na2S2O4). Манометр 5 служит для приведения объемов газовой смеси к постоянному давлению до и после поглощения отдельных компонентов газовой смеси.
Титрометрические способы определения H2S, SO2 и СО основаны на следующих реакциях. Сумма H2S и SО2 определяется посредством протягивания анализируемой пробы через 0,01—нормальный раствор иода в склянках Петри. Реакция с иодом протекает по уравнениям: J2+ 2Н2О + SО2 =
H2SО4 + 2HJ Остаток иода в растворе титруется 0,01 — нормальным раствором гипосульфита натрия (Na2S2O3). Количество SО2 и H2S в пробе определяется по убыли иода. Метод позволяет определить наличие сероводорода и сернистого газа с точностью до 0,0001%. Для определения титрометрическим способом окиси углерода проба протягивается через нагретую трубку с пятиокисью иода. При реакции с пятиокисью иода окись углерода образует точно такое же количество углекислого газа J2О5 + 5CO = 5CО2 + J2. Углекислый газ поглощают титрованным раствором едкого барита Ba(OH)2·8H2О и титруют соляной кислотой (HC1). Раздельный анализ на сероводород и сернистый газ производится весовым способом. Проба газовой смеси пропускается последовательно через склянки Петри с раствором бертолетовой соли (KClO3) и склянки с аммиачным раствором перекиси водорода. Сернистый газ реагирует с бертолетовой солью по уравнению КСlО3 + 3H2О + 3SО2 = 3H2SO24+ KCI. Сероводород почти не реагирует с бертолетовой солью и взаимодействует с перекисью водорода: 4Н2О2 + H2S = H2SО4 + 4Н2О. После поглощения газов к каждому из растворов отдельно приливают хлористый барий (ВаС12), в результате чего серная кислота выпадает из растворов в виде нерастворимого осадка: BaCl2+H2SO4 = 2HCI + BaSO4 По взвешиванию отфильтрованного и просушенного осадка BaSO4 вычисляются количества сернистого газа и сероводорода, израсходованные на образование серной кислоты. Для быстрого определения окиси углерода с точностью до 0,01 % удобен термохимический метод, основанный на каталитическом окислении окиси углерода смесью двуокиси марганца (MnO2) и окиси меди (CuO) и замере температуры реакции при помощи точного ртутного термометра или термостолбика. Принцип термоиндикации использован для конструирования переносных определителей окиси углерода. Лабораторные и переносные термоиндикаторы калибруются путем точного определения СО по методу поглощения пятиокисью иода и определения СО2. Качественное и полуколичественное определение окислов азота производится путем поглощения их 0,5%-м раствором едкого калия или натрия, нейтрализации раствора крепкой уксусной кислотой (C2H4O2) и окрашивания нагретого раствора так называемым реактивом Грисса (смесь растворов сульфаниловой кислоты (NH2·С6Н2·НSO3) в уксусной и альфа-нафтиламина (C10H2·NH2) в воде. При наличии окислов азота смесь приобретает красную, розовую или желтую окраску, в зависимости от концентрации окислов азота. Для грубо количественного определения окиси углерода можно использовать реакцию осаждения металлического палладия из раствора хлористого палладия (PdCl2) и уксуснокислого натрия (NaC2H3O2) в воде: PdCl2+СО+H2O+2NaC2H3O2=Pd+СО2+2NaCl+2С2Н4O2. В присутствии СО на стенках сосуда с раствором с большей или меньшей скоростью образуется налет палладия. Для той же цели могут быть использованы растворы в воде азотнокислого серебра (AgNO3), едкого натрия и аммиака, в результате смещения которых образуется серебряно-аммиачный гидрат [Ag(NH3)2OH]; последний, реагируя с СО, дает осадок металлического серебра, вызывающий более или менее интенсивное помутнение раствора: 2Ag (NH3)2 ОH+СО+3H2О=2Ag+СО2+4NH4OH. Кроме перечисленных простейших анализов состава рудничного воздуха, лаботаториям горноспасательных станций приходится иногда производить более сложные работы по раздельному определению в смесях метана, этилела, этана, тяжелых углеводородов и водорода. |
Сайт горноспасателей
Бывший СССР - Россия, Казахстан, ...
Посвящается командиру Бестобинского военизированного горноспасательного взвода филиала «Жолымбетский ВГСО» РГКП «ЦШ ПВАСС» Галимжану Даржимановичу Гемалетдинову. Галимжан Даржиманович посвятил горноспасательной службе более 36 лет. Сейчас уже сложно подсчитать сколько раз он участвовал в ликвидации сложнейших аварийных ситуаций на шахтах обслуживаемых опасных объектов промышленности.